11 log 2 C. Jika tetapan ionisasi kb basa lemah tersebut adalah 10-5 maka pH larutan itu adalah.
 Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
Konsentrasi kation dari garam Selanjutnya konsentrasi ion H dapat ditulis.

Tetapan ionisasi basa (kb) nh4oh = 10^-5. 7 log 5. 8 log 2 D. Di bawah ini adalah rumus derajat ionisasi dengan kembali mengingat konsep MBS Mula-mula Bereaksi Sisa.
Larutan penyangga asam Dapat digunakan tetapan ionisasi dalam menentukan konsentrasi ion H dalam suatu larutan dengan rumus berikut. NH4OH 01 M Urutan larutan dimulai dari. Tetapan ionisasi basa Kb NH4OH 10-5.
Jika Kh 10-9 berapakah pH larutan garam tersebutJawab larutan NH4Cl bersifat asam jadi H Kh x a garam 10-9 x 1 10-3 10-6pH -log 10-6 6. Hubungan derajat ionisasi dengan Ka dan Kb. Tetapan ionisasi basa Kb NH4OH 10-5.
210 -7 dan Kb NH4OH 10-5. Harga tetapan ionisasi asam benzoat yaitu. G jumlah mol asam konjugasi.
Tabel Tetapan Ionisasi Asam Lemah dan Basa Lemah. Tetapan ionisasi basa kb NH4OH 10 pangkat -5. Jika tetapan kesetimbangan ionisasi basa amonium hidroksida 49.
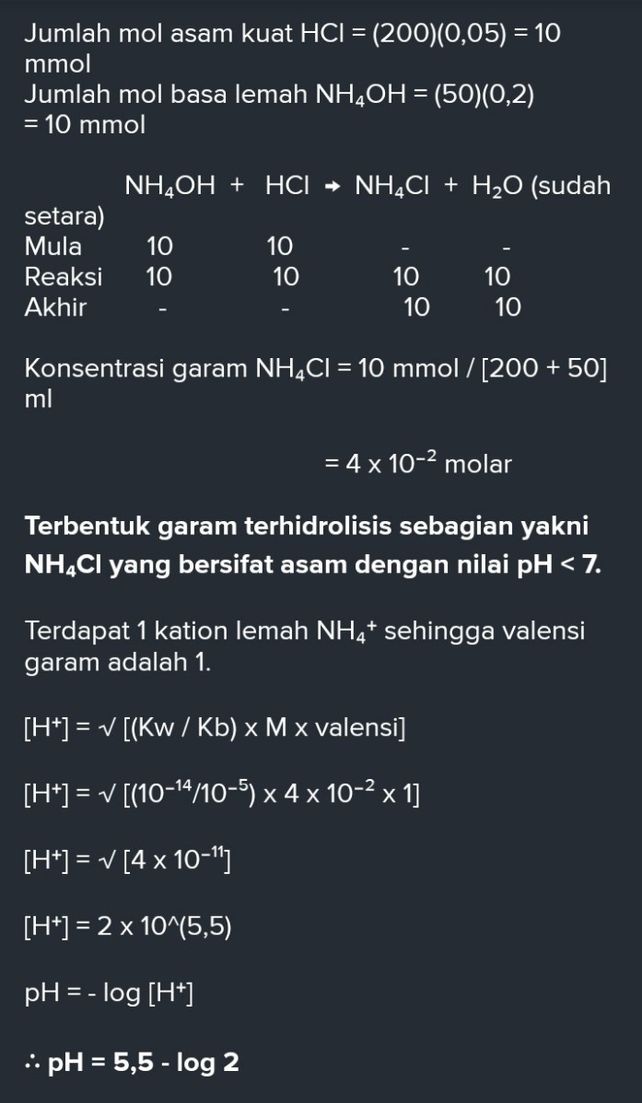
100 mL larutan CH3COOH 01 M dicampurkan dengan 50 mL larutan BaOH2 01 MTentukan pH campuran. Tetapan ionisasi air 10-14 Ka tetapan ionisasi asam A- konsentrasi ion garam yang terhidrolisis Lembar Kerja Peserta Didik Hidrolisis Untuk Kelas XI 18 Contoh 1. Jika 50 mL larutan NH4OH 02 M dicampur dengan 200 mL larutan HCI 005 M maka akan terbentuk larutan dengan pH.
Sifat Asam basa atau Netral garam yang tersusun dari asam lemah dan basa lemah bergantung pada Nilai pH. Tetapan kesetimbangan air. Tetapi sebelum kita mencari Ka dan derajat ionisasi dari suatu asambasa lemahalangkah baiknya kita ketahui dulu apa itu derajat ionisasi a dan apa itu tetapan ionisasi KaKb.
NH4 H2O NH4OH H H akar Kwkb x Mgaram x valensi 10-5 akar 10-1410-5 x M garam x 1 10-52 10-9 x M garam M garam 101010-9 M garam 10-1 01 M. Dan Kb Konstanta ionisasi Basa Lemah. 16Asam HX 01 M mengalami ionisasi 1 harga tetapan ionisasi HX adalah.
Suatu larutan basa lemah KOH mempunyai konsentrasi 01 M. 7 log 5. Menurut Brownsted- Lowry reaksi asam basa yang melibatkan transfer proton membentuk keadaan kesetimbangan.
Jika 50 cm kubik larutan NH4OH 02 M dicampur dengan 200 cm kubik larutan HCL 005M maka akan terbentuk larutan - 9857186. Ka tetapan ionisasi asam lemah a jumlah mol asam lemah g jumlah mol basa konjugasi 7. Menghitung pH Larutan Penyangga 1.
11 log 5. Mmol NH42SO4 VXM 100ml x 02 20 mmol. Hello Sobat.
10-5 derajat ionisasi NH4OH dan konsentrasi ion OH- secara berturut turut yaitu. Nilai pH bergantung pada Ka tetapan ionisasi asam lemah dan Kb tetapan ionisasi basa lemah. HCl g NH3 g NH4Cl s HCl Asam.
Jika 50cm kubik larutan NH4OH 02M dicampur dengan 200cm kubik larutan HCL 005 M maka akan terbentuk - 2439448. Tetapan kesetimbangan air Kb. Asam iodat HIO3 169 x 10-1.
MENCARI mol dari masing-masing larutan Dik. Mmol NH4OH V X M 05 ml x 01 5mmol. Tetapan ionisasi basa NH4.
H 10-5. Asam trikloro asetat HC2O2Cl3 22 x 10-1. Tetapan hidrolisis Kw.
RUMUS DERAJAT IONISASI α F. 11 log 2 B. Pada postingan kali ini kamu akan mempelajari cara mencari KaKb serta derajat ionisasi dari larutan asam dan basa lemah.
Semakin besar Kb maka semakin kuat basa tersebut. Jika Kb NH4OH 10-5. 11 Jika harga Kb NH3 2 105 maka pH larutan NH3 02 M adalah.
B jumlah mol basa lemah. Asam dikloro asetat HC2HO2Cl2 5 x 10-2. Jika diketahui pH NH42SO4 5 Kb NH4OH 10-5 dan Mr NH42SO4 132 massa amonium sulfat yang harus dilarutkan dalam 250 mL air adalah.
50 ml NH4OH 01 Molar dicampur dgn 100ml NH42SO4 02 Molar. V 1 Liter 1000 mL M gramMr x 1000V 01 gram533 x 10001000 gram 01 x 535. Kb tetapan ionisasi basa lemah.
Bila Ka Kb maka H OH- dan maka nilai pH 7 dan sifat larutan adalah Asam. Tetapan kesetimbangan basa Kw. Konsentrasi ion H dalam larutan 00005 M H2SO4 sama dengan dalam larutan 025 M asam benzoat C6H5COOH.
H Ka x ag atau pH p Ka - log ag dengan. NH4Cl NH4 Cl-asam konjugasi kuat basa konjugasi lemah. Pembahasan Menentukan pOH dari basa lemah terlebih dahulu melalui tetapan ionisasi basa yang diketahui.
Dejarat ionisasi memiliki hubungan dengan tetapan kesetimbangan asam-basa yang berguna untuk mencari. Tetapan ionisasi basa B. 3 log 2 Pembahasan Menentukan pOH dari basa lemah terlebih dahulu melalui tetapan.
8 log 2 E. Ar N14 O16 H1 2. Ka CH3COOH 10-5 Penyelesaian.
Konsentrasi kation dari garam ContohTerdapat 4 Lt larutan NH4Cl 0001 M. B B B B. NH4Cl Garam Pada reaksi tersebut molekul HCl bertindak sebagai donor proton asam dan molekul NH3 bertindak sebagai akseptor proton basa.
 Tetapan Ionisasi Basa Kb Nh4oh 10 Pangkat 5 Jika 50cm Kubik Larutan Nh4oh 0 2m Dicampur Brainly Co Id
Tetapan Ionisasi Basa Kb Nh4oh 10 Pangkat 5 Jika 50cm Kubik Larutan Nh4oh 0 2m Dicampur Brainly Co Id
 Diketahui Kb Nh4oh 10 5 Dan Ka Ch3cooh 2 10 5 Hitunglah Molaritas Dan Ph Garam Yg Terbentuk Dari Brainly Co Id
Diketahui Kb Nh4oh 10 5 Dan Ka Ch3cooh 2 10 5 Hitunglah Molaritas Dan Ph Garam Yg Terbentuk Dari Brainly Co Id
 Reaksi Ionisasi Nh4oh Rumah Soal
Reaksi Ionisasi Nh4oh Rumah Soal
 Larutan Nh4oh 0 1 M Terionisasi 1 Tetapan Ionisasi Basa Kb Nh3 Adalah A 1 X 10 6b 1 X Brainly Co Id
Larutan Nh4oh 0 1 M Terionisasi 1 Tetapan Ionisasi Basa Kb Nh3 Adalah A 1 X 10 6b 1 X Brainly Co Id
 Sebanyak 300mi Larutan N Descubre Como Resolverlo En Qanda
Sebanyak 300mi Larutan N Descubre Como Resolverlo En Qanda
 Harga Tetapan Ionisasi Asam Ka Ch3cooh 1 8 X 10 5 Harga Tetapan Ionisasi Basa Kb Nh4oh Brainly Co Id
Harga Tetapan Ionisasi Asam Ka Ch3cooh 1 8 X 10 5 Harga Tetapan Ionisasi Basa Kb Nh4oh Brainly Co Id
 Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
 Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
 Larutan Nh4oh 0 1 M Terionisasi 1 Tetapan Ionisasi Basa Kb Nh3 Adalah Brainly Co Id
Larutan Nh4oh 0 1 M Terionisasi 1 Tetapan Ionisasi Basa Kb Nh3 Adalah Brainly Co Id
 Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
 Harga Tetapan Ionisasi Asam Ka Ch3cooh 1 8 X 10 5 Harga Tetapan Ionisasi Basa Kb Nh4oh 1 X Brainly Co Id
Harga Tetapan Ionisasi Asam Ka Ch3cooh 1 8 X 10 5 Harga Tetapan Ionisasi Basa Kb Nh4oh 1 X Brainly Co Id
 1 Kedalam 100 Ml Larutan Nh4oh 0 1 M Kb Nh4oh 10 5 Dicampurkan Dengan 50 Ml Larutan H2so4h Brainly Co Id
1 Kedalam 100 Ml Larutan Nh4oh 0 1 M Kb Nh4oh 10 5 Dicampurkan Dengan 50 Ml Larutan H2so4h Brainly Co Id
 3 5 Gram Nh4oh Dilarutkan Dalam 400 Ml Air Dengan Kb Nh4oh 1 X 10 6 Tentukan Harga Ph Larutan Brainly Co Id
3 5 Gram Nh4oh Dilarutkan Dalam 400 Ml Air Dengan Kb Nh4oh 1 X 10 6 Tentukan Harga Ph Larutan Brainly Co Id
 Tetapan Ionisasi Basa Kb Nh4oh 10 5 Jika 50cm3 Larutan Nh4oh 0 2m Dicampur 200cm3 Larutan Hcl 0 05m Brainly Co Id
Tetapan Ionisasi Basa Kb Nh4oh 10 5 Jika 50cm3 Larutan Nh4oh 0 2m Dicampur 200cm3 Larutan Hcl 0 05m Brainly Co Id
 Tetapan Ionisasi Basa Kb Nh4oh 10 5 Jika 50cm3 Larutan Nh4oh 0 2m Dicampur 200cm3 Larutan Hcl 0 05m Maka Terbentuk Larutan Ph
Tetapan Ionisasi Basa Kb Nh4oh 10 5 Jika 50cm3 Larutan Nh4oh 0 2m Dicampur 200cm3 Larutan Hcl 0 05m Maka Terbentuk Larutan Ph
 Larutan Asam Basa Kekuatan Derajat Keasaman Contoh Soal
Larutan Asam Basa Kekuatan Derajat Keasaman Contoh Soal
Jika 100cm3 Larutan Nh4 Descubre Como Resolverlo En Qanda
 Tetapan Ionisasi Basa Kb Nh4oh 10 5 Jika 50cm3 Larutan Nh4oh 0 2m Dicampur 200cm3 Larutan Hcl 0 05m Brainly Co Id
Tetapan Ionisasi Basa Kb Nh4oh 10 5 Jika 50cm3 Larutan Nh4oh 0 2m Dicampur 200cm3 Larutan Hcl 0 05m Brainly Co Id
