3 Berapakah pH larutan CaCH3COO2 01 M dan tulislah reaksi hidrolisisnya Ka CH3COOH 10 x 10-5. Meskipun hanya sebagian kecil dari garam itu yang mengalami hidrolisis tetapi cukup untuk mengubah pH larutan.
 Soal Dan Pembahasan Hidrolisis Garam Kimia
Soal Dan Pembahasan Hidrolisis Garam Kimia
Jika suatu asam kuat dicampur dengan basa lemah maka akan terbentuk larutan garam yang bersifat.
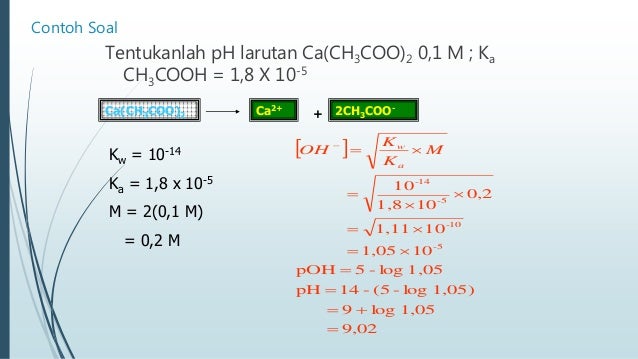
Tentukan nilai tetapan hidrolisis kh dari larutan nh4cl 0 1 m kb nh3 = 1 8 kali 10 pangkat min 5. Tentukan pH campuran setelah bereaksi. 100 mL NaOH 01 M dan 100 mL NaOH 01 M. Campuran berikut yang dapat membentuk larutan penyangga adalah.
Jika tetapan hidrolisis Kh 1 x 10-9 maka pH larutan garam adalah. 100 ml HCl 01 M 100 ml NaOH 01 M d. Jika Kb NH4OH 2x10-5 tentukanlah pH larutan garam tersebut.
Larutan NH4Cl 04 M memiliki tetapan hidrolisis sebesar 109. Rumus tetapan hidrolisis Kh adalah tetapan kesetimbangan dari reaksi hidrolisis. Hitunglah tetapan hidrolisis dan pH larutan 01 M garam tersebut.
Besarnya Kh bergantung pada harga tetapan ionisasi asam Ka atau tetapan ionisasi basa Kb. Terdapat 10 L larutan NH42SO4 01 M. Rumus tetapan hidrolisis Kh adalah.
Jika diketahui Ka CH3COOH 1 x 10-5 pernyataan yang benar tentang reaksi tersebut adalah. Larutan garam NH4Cl 01 M mengalami hidrolisa menurut reaksi. Sedangkan garam yang berasal dari asam kuat atau basa kuat tidak bisa mengalami reaksi hidrolisis.
100 ml HCl 01 M 100 ml NH4OH 01 M e. Hitunglah tetapan hidrolisis garam tersebut dan pH larutannya. PH larutan asam sebelum bereaksi adalah 6.
Besarnya tetapan hidrolisis Kh bergantung pada harga tetapan ionisasi asam Ka atau harga tetapan ionisasi basa Kb. 100 mL NH4OH 01 M. CH3COONa 1 M Ka CH3COOH 1 x 10-5 b.
Jika Kb NH4OH 105 maka larutan garam NH4Cl 01 M mempunyai pH. Hitunglah PH dari larutan NH4Cl 02 M jika diketahui Kb NH3 10 pangkat -5 Karena garam NH4Cl bersifat Asam maka rumus yang kita gunakan untuk mencari PH nya ialah sebagai berikut. 02 M jika Kb NH 3 18 x 10 5 molL.
Ini adalah garam yang berasal dari asam lemah AL dan basa lemahBL. Tentukan pH 100 mL larutan penyangga mengandung NH3 dan NH4Cl masing-masing 01 M. 100 ml HF 01 M 100 ml KOH 01 M c.
Tetapan kesetimbangan dari reaksi hidrolisis disebut tetapan hidrolisis dan dapat dinyatakan dengan lambang Kh. Konsentrasi H dalam larutan tersebut adalah. 100 ml CH3COOH 01 M 100 ml NaOH b.
5 log 2. Apakah akan mengubah derajat hidrolisis ketika 4 liter air ditambahkan ke dalam 1 liter 01 M larutan amonium asetat tersebut. 152 Jawaban.
100 ml HCOOH 01 M 100 ml KOH 01 M Chemistry 2B Nana Sutresna Facil 2010 h. Larutan NaX 01 M terhidrolisis 10. Garam-garam yang mengalami hidrolisis adalah garam yang mengandung ion dari asam lemah atau basa lemah.
Larutan garam NH 4 CH 3 COO terbentuk dari asam asetat dan amoniak. Tentukan nilai tetapan hidrolisis Kh NH4Cl 01 M Kb NH4OH 18. 100 mL NaOH 01 M dan 100 mL HCl 01 M.
Ke dalam 1 liter larutan asam asetat 02 M ditambahkan padatan NaOH 8 gram. Kb NH3 5. Pembahasan Soal Kimia Mudah.
PH dari NH4Cl 04 M adalah kb NH3 10-5. 100 mL NaCN 01 M dan 100 mL HCN 01 M. -Ka CH 3 COOH 175 x 10.
Ion ion yang dihasilkan dari ionisasi garam yang berasal dari asam. Serta tentukan apakah larutan tersebut bersifat asam basa atau netral. Diketahui Ka HCN 40 x 10-10 molL Kb NH3 18 x 10-5 molL adalah.
Tentukan pH larutan NH4Cl 01 M Kb NH3 10-5 - 15344708. Jika diketahui tetapan hidrolisis Kb 10-2 tentukan pH larutan garam tersebut. Nilai suatu pH larutan garam dari asam dan basa bukan kuat dihitung berdasarkan nilai tetapan hidrolisis Kh.
Harga tetapan hidrolisis Kh dapat digunakan untuk menentukan besarnya pH suatu larutan garam. Jika 107 mg garam NH4Cl dilarutkan dalam air hingga 1 L konstanta hidrolisis 10-9 tentukanlah pH larutan garam tersebut. 25 Questions Show answers.
Jika 100 mL NH 4 OH 04 M direaksikan dengan 100 mL larutan HCl 04 M Kb NH 4 OH 2 x 10-6. CaNO32 2 Tuliskan reaksi hidrolisis larutan garam CaCO3 dan tentukan apakah larutannya bersifat asam basa atau netral. 2 log 5.
Hitung persen hidrolisis dari 01 M larutan amonium asetat diketahui K a 172 10 5 K b 18 10 5 dan K w 1 10 14. NH4Cl 01 M Kb NH4OH 1 x 10-5 Pembahasan Soal Kimia Mudah. Sebanyak 25 mL CH3COOH 01 M tepat bereaksi dengan 25 mL NaOH 01 M.
Larutan garam yang berasal dari asam lemah dan basa lemah akan bersifat asam jika. Hitunglah pH larutan. Maka PH nya 14 - 25 log 175 1175 log 175 9.
PH dari larutan garam NH4CN 02M. Konsentrasi dari NH4Cl 04 M jika kb NH3 10-5.
 1 Tentukan Ph Larutan Nh4cl 0 1 M Kb Nh3 10 5 Pakai Caranya Ya Terima Kasih Brainly Co Id
1 Tentukan Ph Larutan Nh4cl 0 1 M Kb Nh3 10 5 Pakai Caranya Ya Terima Kasih Brainly Co Id
 Hitunglah Ph Larutan Ch3coona 1 M Ka Ch3cooh 1x10 Pangkat 5 Brainly Co Id
Hitunglah Ph Larutan Ch3coona 1 M Ka Ch3cooh 1x10 Pangkat 5 Brainly Co Id
 Berapakah Ph Dari Larutan Nh4cl 0 02 M Jika Diketahui Nilai Kb 1 8 X 10 5 Minus Pangkat 5 Brainly Co Id
Berapakah Ph Dari Larutan Nh4cl 0 02 M Jika Diketahui Nilai Kb 1 8 X 10 5 Minus Pangkat 5 Brainly Co Id
 Larutan Nh4cl 0 4m Memiliki Hidrolis Sebesar 10 Pangkat 9 Tentukan Ph Hidrolis Tersebut Brainly Co Id
Larutan Nh4cl 0 4m Memiliki Hidrolis Sebesar 10 Pangkat 9 Tentukan Ph Hidrolis Tersebut Brainly Co Id
 Ph Dari Larutan Garam Nh4cl 0 2 M Jika Diketahui Kb Nh3 1 8 Kali 10 Min 5 Mol Per L Adalah Brainly Co Id
Ph Dari Larutan Garam Nh4cl 0 2 M Jika Diketahui Kb Nh3 1 8 Kali 10 Min 5 Mol Per L Adalah Brainly Co Id
 Berapakah Ph Larutan 0 1m Nh4cl Jika Kb Nh3 1 8 X 10 5 Brainly Co Id
Berapakah Ph Larutan 0 1m Nh4cl Jika Kb Nh3 1 8 X 10 5 Brainly Co Id
 Jika Ka Ch3cooh 1 75 X 10 5 Kb Nh3 1 8 X 10 5 Maka Ph Larutan Garam Ch3coonh4 0 1 M Brainly Co Id
Jika Ka Ch3cooh 1 75 X 10 5 Kb Nh3 1 8 X 10 5 Maka Ph Larutan Garam Ch3coonh4 0 1 M Brainly Co Id
 Hitunglah Ph Larutan Dari A Larutan Nacn 0 1 M Ka Hcn 4 X 10 6 B Ch3coonh 0 1 M Ka Ch3cooh Brainly Co Id
Hitunglah Ph Larutan Dari A Larutan Nacn 0 1 M Ka Hcn 4 X 10 6 B Ch3coonh 0 1 M Ka Ch3cooh Brainly Co Id
 Diketahui Kb Nh3 1 8 X 10 6 Tentukan A Ph Larutan Nh4cl 0 2 M B Tetapan Hidrolisis Kh Brainly Co Id
Diketahui Kb Nh3 1 8 X 10 6 Tentukan A Ph Larutan Nh4cl 0 2 M B Tetapan Hidrolisis Kh Brainly Co Id
 Hidrolisis Garam1 Perkirakan Ph Larutan Berikut A Nh4cn B Nh4f Diketahui Ka Hcn 6 2 X Brainly Co Id
Hidrolisis Garam1 Perkirakan Ph Larutan Berikut A Nh4cn B Nh4f Diketahui Ka Hcn 6 2 X Brainly Co Id
 Hitunglah Ph Larutan Nh4cl 0 5 M Kb 1x10 Pangkat 5 Brainly Co Id
Hitunglah Ph Larutan Nh4cl 0 5 M Kb 1x10 Pangkat 5 Brainly Co Id
 Tetapan Hidrolisis Suatu Garam Yang Diperoleh Dari Asam Lemah Dan Basa Kuat Adalah 1 0 X10 10 Brainly Co Id
Tetapan Hidrolisis Suatu Garam Yang Diperoleh Dari Asam Lemah Dan Basa Kuat Adalah 1 0 X10 10 Brainly Co Id
 Kerjakan Soal Berikut 1 Diketahui Larutan 0 1 M Nh4cl Dan Kb Nh4oh 10 5 A Tuliskan Hidrolisis Brainly Co Id
Kerjakan Soal Berikut 1 Diketahui Larutan 0 1 M Nh4cl Dan Kb Nh4oh 10 5 A Tuliskan Hidrolisis Brainly Co Id
 Seorang Laboran Menggunakan Larutan Amonium Sianida 0 1 M Jika Ka Hcn 10 10 Dan Kb Nh3 10 5 Brainly Co Id
Seorang Laboran Menggunakan Larutan Amonium Sianida 0 1 M Jika Ka Hcn 10 10 Dan Kb Nh3 10 5 Brainly Co Id
 Soal Dan Pembahasan Hidrolisis Garam Kimia
Soal Dan Pembahasan Hidrolisis Garam Kimia
 Menentukan Kh Dan Ph Hidrolisis Garam Kimia Sma Youtube
Menentukan Kh Dan Ph Hidrolisis Garam Kimia Sma Youtube
 Larutan Nh4cl Kb Nh3 10 5 Mempunyai Ph 5 Maka Di Dalam 100 Ml Larutan Tersebut Terlarut Brainly Co Id
Larutan Nh4cl Kb Nh3 10 5 Mempunyai Ph 5 Maka Di Dalam 100 Ml Larutan Tersebut Terlarut Brainly Co Id
 Nilai Ph Larutan Garam Nh4cl 0 1 M Yang Memiliki Tetapan Hidrolisis Kh 10 9 Adalah Brainly Co Id
Nilai Ph Larutan Garam Nh4cl 0 1 M Yang Memiliki Tetapan Hidrolisis Kh 10 9 Adalah Brainly Co Id