OH- Cb. Jika tetapan ionisasi kb basa lemah tersebut adalah 10-5 maka pH larutan itu adalah.
 Sebanyak 100 Ml Nh4oh 0 2 Dicampur Dg 200 Ml Nh4 2so4 0 4 Jika Kb Nh4oh 10 5 Tentukan Ph Brainly Co Id
Sebanyak 100 Ml Nh4oh 0 2 Dicampur Dg 200 Ml Nh4 2so4 0 4 Jika Kb Nh4oh 10 5 Tentukan Ph Brainly Co Id
Tetapan ionisasi basa B.

Tetapan ionisasi basa (kb) nh4oh = 10^-5 jika 50 ml. 50 mL HCl 02 M dan 50 mL NaOH 01 M. 1 times 10-8 15. 9 Jika 200 mL NH4OH 08 M direaksikan dengan 200 mL larutan HCl 08 M Kb NH4OH 105 pH campuran setelah bereaksi adalah.
Jika tetapan ionisasi kb basa lemah tersebut adalah 10 -5 maka pH larutan itu adalah. Berapa gram NH4Cl diperlukan untuk membuat 500 mL larutan dengan pH 5. Sebanyak 028 gram kristal KOH ditambahkan ke dalam 50 ml larutan CH3COOH 01 M Ka10-5.
Dicampurkan 100 mL larutan NH4OH 02 M Kb 10 x 10-5 dengan 100 mL larutan HCI x M larutan yang terjadi mem-punyai pOH 5. B jumlah mol basa lemah. 1 times 10-3 b.
Jika tetapan ionisasi basa lemah BOH adalah 10-5 M maka larutan BOH 01M akan mempunyai pH sebesar. Kb 10-3. B B B B.
Kb 10-5 A. Tetapan ionisasi basa Kb NH4OH 10-5. Suatu larutan basa lemah KOH mempunyai konsentrasi 01 M.
Diketahui tetapan ionisasi basa lemah BOH adalah 10-5 sehingga larutan BOH 01M memiliki pH. 50 ml NH4OH 01 Molar dicampur dgn 100ml NH42SO4 02 Molar. Suatu larutan basa lemah KOH mempunyai konsentrasi 01 M.
1Larutan dengan pH 12 dibuat dengan melarutkan x gram NaOH Mr 40 dalam air sampai 500 mL. Mmol NH42SO4 VXM 100ml x 02 20 mmol. Jika garam yang berasal dari asam kuat dengan basa lemah dilarutkan ke dalam air maka.
1 times 10-7 e. Larutan Buffer Larutan buffer adalah. Jika 50cm kubik larutan NH4OH 02M dicampur dengan 200cm kubik larutan HCL 005 M maka akan terbentuk - 2439.
Jika Kb NH4OH 10-5. 2 times 10-3 C. Jika 100 mL larutan BOH 01 M memiliki konsentrasi ion OH yang sama dengan konsentrasi ion OH dalam 50 mL larutan NaOH 0001 M nilai K b BOH nya adalah.
Jika ke dalam larutan di atas ditambahkan lagi 10 mL HCl 001 M ternyata pH larutan dianggap tidak berubah maka konsentrasi larutan HCl di atas adalah. Harga pH larutan tersebut setelah diencerkan adalah. Kb adalah tetapan ionisasi basa yang berfungsi dalam menghitung OH- dalam pH basa lemah.
Sebanyak 100 mL larutan basa lemah LOH dengan pH 10 diencerkan hingga volume 1000 mL. Kb Kb tetapan ionisasi basa lemah Contoh. Dari tabel di atas garam yang berasal dari basa kuat dan asam lemah adalah Na2CO3 KCN dan CH3COONa.
3 Hitunglah konsentrasi ion OH dalam larutan NH 3 001 M jika Kb 1 10 5. Larutan asam asetat K a 2 times 10-3 mempunyai pH yang sama dengan larutan HCI 2. 210 -7 dan Kb NH4OH 10-5.
Kedalam larutan NH4OH ditambahkan padatan garam NH4. Data selengkapnya seperti berikut. Campuran asam lemah dengan garam dari asam lemah tersebut.
Jika 50 mL larutan NH4OH 02 M dicampur dengan 200 mL larutan HCI 005 M maka akan terbentuk larutan dengan pH. 4 Hitung pH larutan H 2 SO 4 100 ml jika. G jumlah mol asam konjugasi.
Mmol NH4OH V X M 05 ml x 01 5mmol. PH asam formiat 01 M ka 110 -7 adalah. Kb NH3 10-5 Lembar Kerja Peserta Didik Hidrolisis Untuk Kelas XI 22.
Jika Kb NH 4 OH 2 x 10-5 volume HCl yang ditambahkan adalah. Tetapan ionisasi basa kb NH4OH 10 pangkat -5. Diketahui tetapan kesetimbangan basa Kb 10 5 dan ArN 14.
Diketahui Tetapan kesetimbangan asam Ka 10 8 dan ArH 1. Kb tetapan ionisasi basa lemah. Jika 50 cm kubik larutan NH4OH 02 M dicampur dengan 200 cm kubik larutan HCL 005M maka akan terbentuk larutan - 985.
Jika diketahui pH NH42SO4 5 Kb NH4OH 10-5 dan Mr NH42SO4 132 massa amonium sulfat yang harus dilarutkan dalam 250 mL air adalah. Kw tetapan ionisasi 1014 Kb tetapan ionisasi basa B konsentrasi ion garam yang terhidrolisis Contoh 2. Hitunglah pH dari 100 ml 0001 M larutan NH4OH jika diketahui tetapan ionisasinya 10-5.
PH larutan yang terjadi jika diketahui Ar K39 16 dan H1 adalah. Tetapan ionisasi basa Kb NH4OH 10-5. Jika 027 gram Asam Sianida terlarut dalam satu liter larutannya.
Maka besarnya x adalah. Konsentrasi kation dari garam Selanjutnya konsentrasi ion H dapat ditulis. 1 times 10-5 d.
Larutan NH4OH 01 M yang volumenya 400 mL ditambahkan ke dalam 200 mL larutan H2SO4 Larutan NH4OH 01 M yang volumenya 400 mL ditambahkan ke dalam 200 mL larutan H2SO4 ternyata diperoleh larutan penyangga dengan pH 9 2 log 2 Kb 10-5. 10-5 10-4 M pOH - log 10-4 4 pH 14 - pOH 14 - 4 10 D. Jika 70 milligram Ammonium Hidroksida terlarut dalam 200 cm3 larutannya.
Jika pH larutan 001 M suatu asam lemah HA adalah 35 maka tetapan asam K adalah.
 Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
 Tolong Sahabatku 1 Sebanyak 0 1 Mol Nh4oh Dilarutkan Dengan Air Hingga Vilume 500ml Jika Brainly Co Id
Tolong Sahabatku 1 Sebanyak 0 1 Mol Nh4oh Dilarutkan Dengan Air Hingga Vilume 500ml Jika Brainly Co Id
 Jika 50 Cm 3 Larutan Nh4oh 0 2 M Dicampur Dengan 200 Cm 3 Larutan Hcl 0 05 M Maka Akan Terbentuk Brainly Co Id
Jika 50 Cm 3 Larutan Nh4oh 0 2 M Dicampur Dengan 200 Cm 3 Larutan Hcl 0 05 M Maka Akan Terbentuk Brainly Co Id
 Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
 7 Gram Nh4oh Dilarutkan Dalam Air Sebanyak 500ml Jika Kb Nh4oh 5x10 5 Maka Hitunglah Ph Brainly Co Id
7 Gram Nh4oh Dilarutkan Dalam Air Sebanyak 500ml Jika Kb Nh4oh 5x10 5 Maka Hitunglah Ph Brainly Co Id
 Jika 100cm3 Larutan Nh4 Descubre Como Resolverlo En Qanda
Jika 100cm3 Larutan Nh4 Descubre Como Resolverlo En Qanda
 1 Larutan Nh4oh 0 1 M Sebanyak 400 Ml Dicampurkan Dengan 800 Ml Larutan Nh4 2so4 0 05 Jika Brainly Co Id
1 Larutan Nh4oh 0 1 M Sebanyak 400 Ml Dicampurkan Dengan 800 Ml Larutan Nh4 2so4 0 05 Jika Brainly Co Id
 Reaksi Ionisasi Nh4oh Rumah Soal
Reaksi Ionisasi Nh4oh Rumah Soal
 Jika Tetapan Ionisasi Ba Descubre Como Resolverlo En Qanda
Jika Tetapan Ionisasi Ba Descubre Como Resolverlo En Qanda
 Tetapan Ionisasi Basa Kb Nh4oh 10 Pangkat 5 Jika 50cm Kubik Larutan Nh4oh 0 2m Dicampur Brainly Co Id
Tetapan Ionisasi Basa Kb Nh4oh 10 Pangkat 5 Jika 50cm Kubik Larutan Nh4oh 0 2m Dicampur Brainly Co Id
 1 Kedalam 100 Ml Larutan Nh4oh 0 1 M Kb Nh4oh 10 5 Dicampurkan Dengan 50 Ml Larutan H2so4h Brainly Co Id
1 Kedalam 100 Ml Larutan Nh4oh 0 1 M Kb Nh4oh 10 5 Dicampurkan Dengan 50 Ml Larutan H2so4h Brainly Co Id
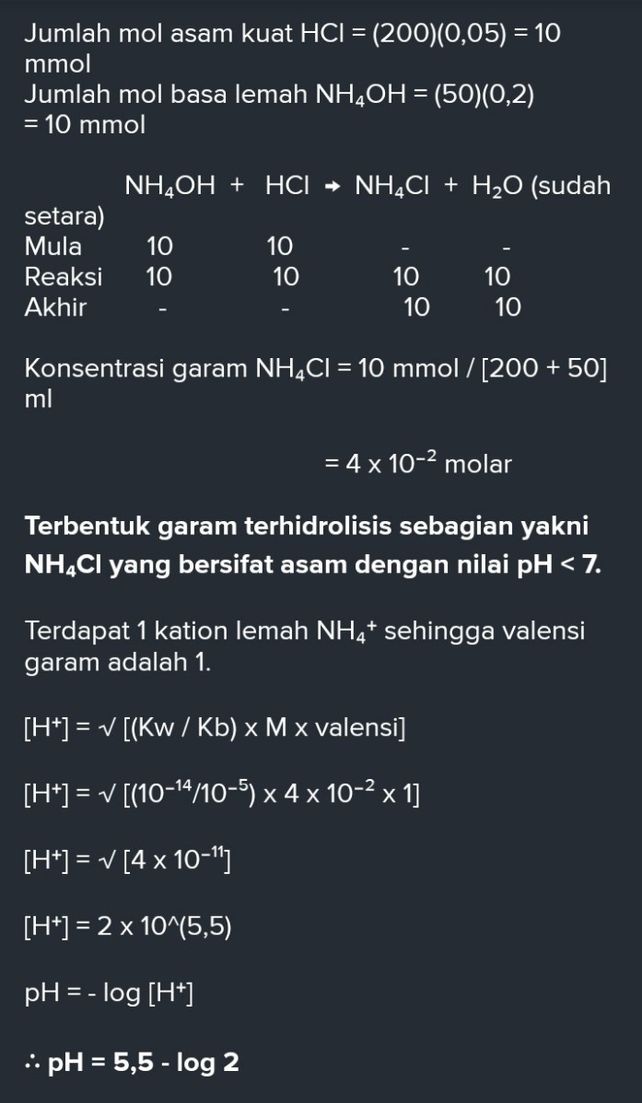 Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
 Larutan Nh4oh 0 1 Sebanyak 200 Ml Di Campur Kan Kedalam Larutan Hcl 0 1 M Sebnyak 100 Ml Dari Brainly Co Id
Larutan Nh4oh 0 1 Sebanyak 200 Ml Di Campur Kan Kedalam Larutan Hcl 0 1 M Sebnyak 100 Ml Dari Brainly Co Id
 Reaksi Ionisasi Nh4oh Rumah Soal
Reaksi Ionisasi Nh4oh Rumah Soal
 Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
Tetapan Ionisasi Basa K Descubre Como Resolverlo En Qanda
 Sebanyak 50 Ml Larutan Nh4oh 0 4 M Dicampur Dengan 50 Ml Larutan H2so4 0 1 M Jika Kedalam Larutan Brainly Co Id
Sebanyak 50 Ml Larutan Nh4oh 0 4 M Dicampur Dengan 50 Ml Larutan H2so4 0 1 M Jika Kedalam Larutan Brainly Co Id
 Jika Tetapan Ionisasi Ba Descubre Como Resolverlo En Qanda
Jika Tetapan Ionisasi Ba Descubre Como Resolverlo En Qanda
