Pada persamaan laju reaksi orde reaksi. Artinya jika konsentrasi pereaksi dinaikkan dua kali semula maka laju reaksi juga akan meningkat besarnya sebanyak 2 1 atau 2 kali semula juga.
 D A V D B D C 1 Laju Reaksi 2 Hukum Laju Dan Orde Reaksi Ppt Download
D A V D B D C 1 Laju Reaksi 2 Hukum Laju Dan Orde Reaksi Ppt Download
Pada percobaan pertama dilakukan pengamatan pengaruh konsentrasi terhadap laju reaksi yaitu dilakukan dengan cara mereaksikan pita magnesium Mg dengan HCl yang konsentrasinya berbeda-beda.

Satuan tetapan laju reaksi orde 1. C 4H 9Cl H 2O - C 4H 9OH HCl. Satuan laju reaksi adalah Ms Molar per detik. Pada tabung 1 laju reaksi bejalan sangat lambat yaitu 234s pada tabung kedua laju reaksi berjalan agak cepat yaitu 104s pada tabung 3 laju reaksi.
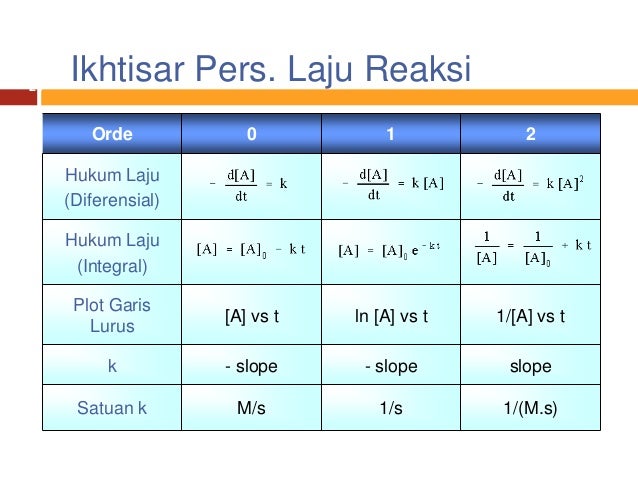
Suatu reaksi kimia dikatakan mempunyai orde satu apabila besarnya laju reaksi berbanding lurus dengan besarnya konsentrasi pereaksi. V k A x B y v laju reaksi k tetapan laju reaksi satuan k tergantung dari orde reaksi keseluruhan dari persamaan laju reaksi A B konsentrasi pereaksi A dan B x orde reaksi terhadap zat A y orde reaksi terhadap zat B xy orde reaksi total Besarnya pengaruh konsentrasi reaktan terhadap laju reaksi dinyatakan sebagai orde reaksi. Suatu reaksi mempunyai nilai tetapan laju reaksi k dengan satuan mol-1 dm 3 det-1.
Besarnya orde reaksi tergantung dari besarnya laju reaksi apabila diberi perlakuan terhadap konsentrasi reaktannya. Satuan tetapan jenis reaksi k tergantung pada tingkat reaksi. Karena reaksi tersebut berorde 2 maka persamaan laju reaksinya adalah.
Sebagaimana yang kita ketahui reaksi kimia berlangsung dari arah reaktan menuju produk. Reaksi orde satu. Suatu reaksi kimia dikatakan mempunyai orde satu apabila besarnya laju reaksi berbanding lurus dengan besarnya konsentrasi pereaksi.
Laju Reaksi Dikatakan Sebagai Orde Satu. Satuan dari k dapat membantu dalam penentuan orde reaksi. Laju reaksi didefinisikan sebagai perubahan konsentrasi reaktan atau produk per satuan waktu.
M An B pCqD Persamaan laju reaksinya dapat dirumuskan sebagai. Reaksi tersebut merupakan reaksi orde. Ini berarti selama reaksi kimia berlangsung reaktan digunakan dikonsumsi bersamaan dengan pembentukan sejumlah produk.
Luthfia ulva irmitampdvideo ini berisi pengertian orde reaksi cara menentukan orde reaksi persamaan laju reaksi. Reaksi tersebut merupakan reaksi orde. Tetapan laju reaksi untuk reaksi orde 2.
Artinya jika konsentrasi pereaksi dinaikkan dua kali semula maka laju reaksi juga akan meningkat besarnya sebanyak 2 1 atau 2 kali semula juga. Tentukan masing-masing orde reaksi dari suatu persamaan reaksi yang diketahui nilai tetapan laju reaksi k seperti berikut ini. M detik -1 M-1 detik M-2 detik -2 M-1 detik-1.
Orde reaksi 1 atau suatu reaksi orde satu terhadap salah satu pereaksinya jika laju reaksinya berbanding lurus dengan konsentrasi pereaksi itu. Berapa tetapan laju reaksi agar konsentrasi NO2 berkurang dari 062 M menjadi 028 M. Bila diplot akan terbentuk kurva berikut.
2NO2 g - 2NO g O2 g pada suhu 300 C adalah 054 M-1s-1. V kNO 2 Br 2 reaksi orde 3 b. Untuk menentukan nilai k cukup kita ambil salah satu data percobaan saja misalnya data 1 maka.
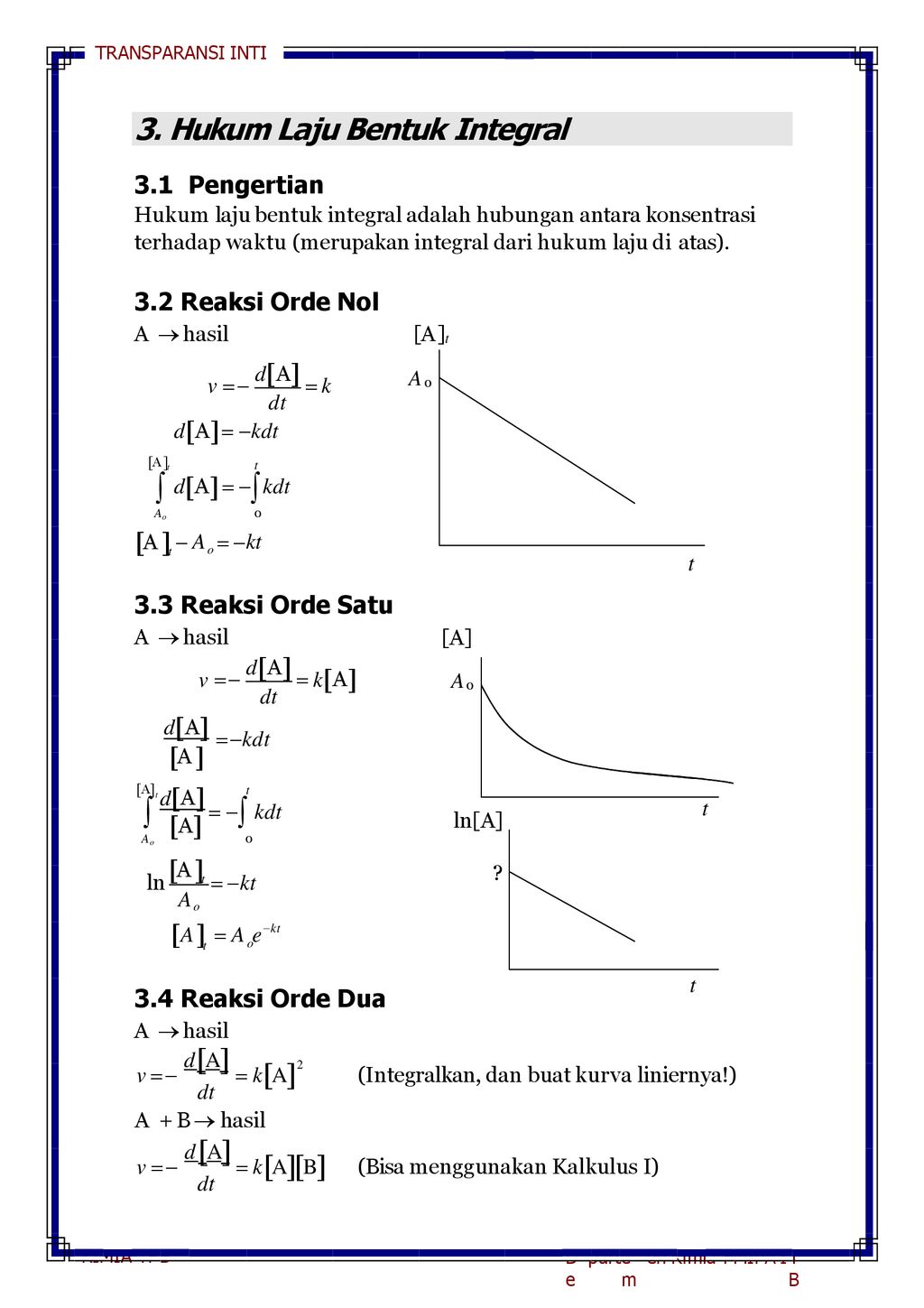
Sebagai contoh bila konsentrasi pereaksi dilipat-duakan maka laju reaksi akan menjadi 21 2 kali lipatnya. Pembentukan butil alkohol dari butil klorida dan air merupakan reaksi orde 1 terhadap butil klorida. Pada reaksi kimia dengan orde nol laju reaksi akan tetap walaupun telah dilakukan perlakuan terhadap konsentrasi reaktannya.
Sebagaimana yang kita ketahui reaksi kimia berlangsung dari arah reaktan menuju produk. Pada tabung 1 terdapat hcl 05M pada tabung 2 terdapat HCl 1M pada tabung 3 terdapat HCl 2M dan pada tabung 4 terdapat HCl 3M. 18 Orde reaksi m 1 Laju reaksi berbanding lurus dengan konsentrasi reaktan.
V kNO 2 Br 2 12 k01 2 01 k 12 x 10 3 mol-2 1 2 det-1 Faktor faktor yang mempengaruhu laju reaksi. A k 32 10 4 s 1 b k 65 10 2 mol L 1 s 1 c k 43 10 5 L mol 1 s 1 d k 37 10 3 L 2 mol 2 s 1 Penyelesaian Soal 1. 2 y 2 y 1 reaksi orde 1 terhadap Br 2Jadi rumus kecepatan reaksinya.
Tetapan laju adalah tetapan perbandingan antara laju reaksi dan hasi kali konsentrasi spesi yang mempengaruhi laju reaksi. A B - dAdt k A 1 k A ln A -kt C Contoh. V k NO₂² V 054 062² 0208.
Satuan laju reaksi adalah Ms Molar per detik. Tetapan laju juga merupakan perubahan konsentrasi pereaktan atau produk reaksi per satuan waktu dalam suatu reaksi jika konsentrasi semua pereaksi sama dengan satu. Dengan demikian laju reaksi.
Ini berarti selama reaksi kimia berlangsung reaktan digunakan dikonsumsi bersamaan dengan pembentukan sejumlah produk. Satuan tetapan jenis reaksi untuk reaksi tingkat 2 adalah.
 Menentukan Satuan Tetapan Laju Reaksi Orde Pertama Ksm 2014 Kabupaten Kota Youtube
Menentukan Satuan Tetapan Laju Reaksi Orde Pertama Ksm 2014 Kabupaten Kota Youtube
 Rumus Laju Reaksi Orde 1 Edukasi Lif Co Id
Rumus Laju Reaksi Orde 1 Edukasi Lif Co Id
 Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info

 Reaksi Orde Tiga Mempunyai Satuan Tetapan Laju Reaksi Brainly Co Id
Reaksi Orde Tiga Mempunyai Satuan Tetapan Laju Reaksi Brainly Co Id
 Persamaan Laju Reaksi Dan Grafik Orde Konsep Mudah Youtube
Persamaan Laju Reaksi Dan Grafik Orde Konsep Mudah Youtube
 Menentukan Nilai Dan Satuan Konstanta Laju Reaksi Laju Reaksi Part 21 Youtube
Menentukan Nilai Dan Satuan Konstanta Laju Reaksi Laju Reaksi Part 21 Youtube
 Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
 Pengantar Kinetika Kimia Ii Orde Reaksi Waktu Paruh Ppt Download
Pengantar Kinetika Kimia Ii Orde Reaksi Waktu Paruh Ppt Download
 Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
 Bab 3 Laju Reaksi Bahan Ajar Mata Pelajaran
Bab 3 Laju Reaksi Bahan Ajar Mata Pelajaran
 Rumus Laju Reaksi Orde Nol Edukasi Lif Co Id
Rumus Laju Reaksi Orde Nol Edukasi Lif Co Id
 Kinetika Reaksi Tri Yulianti Sf Apt Ppt Download
Kinetika Reaksi Tri Yulianti Sf Apt Ppt Download
 Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
 Kelas 11 Ini Hal Hal Penting Yang Perlu Kamu Tahu Tentang Kelajuan Reaksi
Kelas 11 Ini Hal Hal Penting Yang Perlu Kamu Tahu Tentang Kelajuan Reaksi