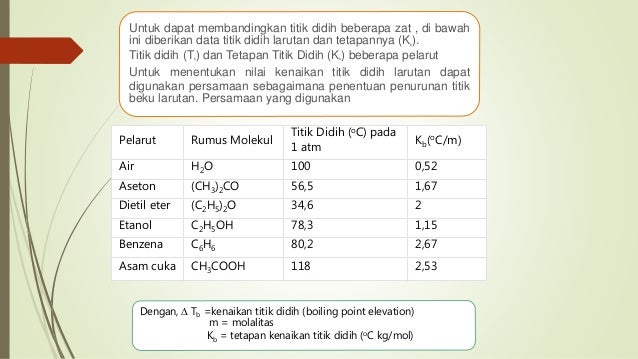
Keterangan ΔT b kenaikan titik didih larutan T b titik didih larutan. Berlawanan dengan penurunan titik beku larutan kenaikan titik didih larutan merupakan fenomena meningkatkan titik didih suatu pelarut disebabkan adanya zat terlarut didalam pelarut tersebut.
 Titik Didih Pengertian Kenaikan Rumus Dan Contoh Soal
Titik Didih Pengertian Kenaikan Rumus Dan Contoh Soal
Besarnya tetapan kenaikan titik didih.

Cara mencari tetapan kenaikan titik didih molal. Maka titik didih dari larutan potassium sulfat adalah titik didih air selisih titik didihnya 100 0312 100312 derajat celcius. Tetapan kenaikan titik didih molal C atau konstanta ebulioskopi yaitu kenaikan titik didih untuk 1 mol zat dalam 1000 gram pelarut. Kenaaikan titik didih adalah selisih antara titik didih larutan dan titik didih pelarutnya.
Ini berarti bahwa titik didih pelarut. Tampak bahwa K d air 052 C m 1. Harga Kb ini tergantung pada jenis pelarut.
Aseton Kb 172 Cmolal. K b tetapan kenaikan titik didih molal pelarut kenaikan titik didih untuk 1 mol zat dalam 1000 gram pelarut m molal larutan mol100 gram pelarut Perubahan titik didih atau ΔTb merupakan selisih dari titik didih larutan dengan titik didih pelarutnya seperti persamaan. Konsep mudah menentukan kenaikan titik didih molal air pada percobaan 1 terhadap gula sebesar 5 gram dengan pelarut air 48 gram dan mendidih suhu 1003 C sed.
Menurut Hukum Backman dan Raoult bahwa penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang terlarut di dalamnya. Hukum tersebut dapat dirumuskan sebagai berikut. Kenaikan Titik Didih Tb dan Penurunan Titik Beku Tf Larutan Contoh Soal Praktikum Kimia - Suatu zat cair dikatakan mendidih jika tekanan uapnya sama dengan tekanan atmosfer tekanan udara luar di atas permukaan cairan.
Air Kb 052 Cmolal. Molalitas urea 45601000250. Kb adalah konstanta kenaikan titik didih molal dan m adalah molalitas larutan.
Jika diketahui Kf air 186 dan Ar H 1 O 16 Cl 355 maka pernyataan berikut yang benar kecualiLarutan glukosa dalam air mendidih pada 10026 derajat C. Perlu diketahui bahwa sistem larutan suhunya tidak dijaga tetap sehingga kita tidak dapat menyatakan satuan konsentrasi bukan dalam molaritas karena molaritas berubah jika suhu berubah atau terkait dengan volume jadi jika dipanaskandidinginkan volume akan berubah. Kenaikan titik didih ini dirumuskan.
Tetapan Kenaikan Titik Didih Molal K d Beberapa Pelarut Pada Tabel 1. Molalitasmolal larutan mol per 100 gram pelarut Kb. Kb tetapan kenaikan titik didih molal Cmolal Tetapan kenaikan titik didih molal adalah nilai kenaikan titik didih jika molaritas larutan sebesar 1 molal.
Molalitas Urea dihitung dengan cara seperti beriktut. ΔTd titik didih larutan titik didih pelarut murni 4. Jika Kb 052 dan Kf 186 maka larutan tersebut akan membeku pada suhuAsam benzoat Mr 122 sebanyak 122 gr dilarutkan dalam 122 g etanol menyebabkan kenaikan titik didih 1 derajat C.
ΔT b T b T b o m K b. Tetapan kenaikan titik didih molal adalah nilai kenaikan titik didih jika molaritas larutan sebesar 1 molal. Tabel Tetapan Kenaikan Titik Didih Kb Beberapa Pelarut.
Harga Kb ini tergantung pada jenis pelarut. Dengan kata lain titik didih larutan sebesar 10052 C. Tb kenaikan titik didih o C kb tetapan kenaikan titik didih molal o C kgmol m molalitas larutan molkg Mr massa molekul relatif.
Dari hasil penelitian ternyata titik didih larutan selalu lebih tinggi dari titik didih pelarut murninya Hal ini disebabkan adanya partikel partikel zat terlarut dalam suatu larutan menghalangi peristiwa penguapan partikel partikel pelarut Oleh karena itu penguapan partikel partikel pelarut membutuhkan energi yang lebih besar. P jumlah massa zat kg Tabel Tetapan Kenaikan Titik Didih Kb Beberapa Pelarut. Rumus Menentukan Kenaikan Titik Didih Larutan Elektrolit Alumunium Sulfat.
Jika ingin menentukan penurunan titik bekunya dapat ditentukan dari konsentrasi molalnya. Jika tetapan titik beku molal air 186Cm derajat ionisasi garam MgCl2 adalah. ΔTb Kb x m x i.
ΔTb kenaikan titik didih Kb tetapan kenaikan titik didih molal ΔTf penurunan titik beku Kf tetapan titik beku molal m molalitas. Persamaannya Kenaikan Titik Didih dapat ditulis. Kenaikan titik didih terjadi akibat penurunan tekanan uap.
Jumlah ion dalam larutan yang dihasilkan dari setiap satuan rumus kimia seyawa terlarut. Dalam 250 gram air dilarutkan 19 gram MgCl2 ternyata larutan membeku pada 0372C. Adapun suatu zat dikatakan membeku jika partikel-partikel zat itu berada dalam kisi-kisi kesetimbangan sehingga tidak terjadi gerakan partikel.
Tetapan kenaikan titik didih molal Kb adalah nilai kenaikan titik didih jika molalitas larutan sebesar 1 molal. Kenaikan titik didih Tb larutan Tb pelarut m. Pada larutan encer kenaikan titik didi larutan ΔTb sama dengan molalitas m larutan yang mengandung pertikel zat terlarut nonvolatil dikalikan dengan tetapan kenaikan titik didih molal K b.
Satuan Kb adalah oCm. Artinya suatu larutan dalam air dengan konsentrasi satu molal akan mendidih pada suhu lebih tinggi sebesar 052 C dari titik didih air. Menurut hokum Raoult Besarnya kenaikan titik didih larutan sebanding dengan hasil kali dari molaritas larutan m dan kenaikan titik didih molal.
Mg 24 Cl 355.
 Contoh Soal Kenaikan Titik Didih
Contoh Soal Kenaikan Titik Didih
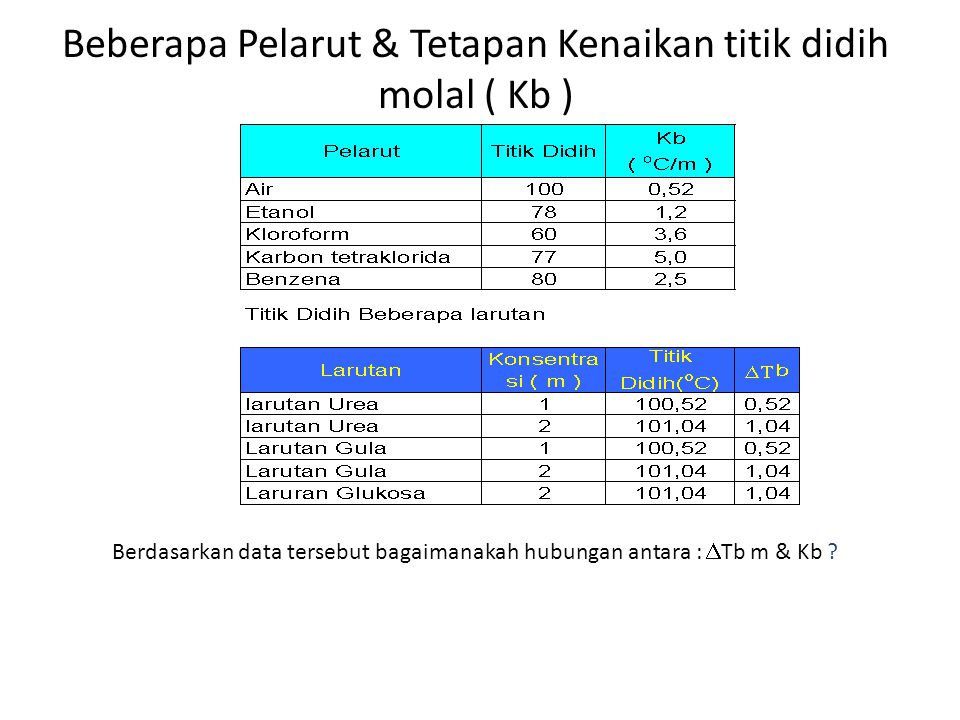 Kimia Kelas Iii Ipa Semester I Ppt Download
Kimia Kelas Iii Ipa Semester I Ppt Download
 Jika Diketahui Tetapan Kenaikan Titik Didih Molal Air Kf Adalah 0 52 Derajat Celcius M Pangkat Min Brainly Co Id
Jika Diketahui Tetapan Kenaikan Titik Didih Molal Air Kf Adalah 0 52 Derajat Celcius M Pangkat Min Brainly Co Id
 Jika Diketahui Tetapan Kenaikan Titik Didih Molal Air Kf Adalah 0 52 Derajat Celcius M Pangkat Min Brainly Co Id
Jika Diketahui Tetapan Kenaikan Titik Didih Molal Air Kf Adalah 0 52 Derajat Celcius M Pangkat Min Brainly Co Id
 Pembahasan Kimia Un 2019 No 21 25
Pembahasan Kimia Un 2019 No 21 25
 Kenaikan Titik Didih Larutan Nonelektrolit
Kenaikan Titik Didih Larutan Nonelektrolit
 Titik Didih Pengertian Kenaikan Rumus Dan Contoh Soal
Titik Didih Pengertian Kenaikan Rumus Dan Contoh Soal
 Sifat Koligatif Larutan Pengertian Rumus Contoh Soal
Sifat Koligatif Larutan Pengertian Rumus Contoh Soal

 Tetapan Kenaikan Titik Didih Molal Benzena Adalah 2 7 C Molal Larutan 3 Gram Zat X Dalam 100 Gram Brainly Co Id
Tetapan Kenaikan Titik Didih Molal Benzena Adalah 2 7 C Molal Larutan 3 Gram Zat X Dalam 100 Gram Brainly Co Id
 Contoh Soal Kenaikan Titik Didih Larutan Sifat Koligatif Larutan Elektrolit Youtube
Contoh Soal Kenaikan Titik Didih Larutan Sifat Koligatif Larutan Elektrolit Youtube

 Sifat Koligatif Larutan Ppt Download
Sifat Koligatif Larutan Ppt Download
 2y Tetapan Kenaikan Titik Lihat Cara Penyelesaian Di Qanda
2y Tetapan Kenaikan Titik Lihat Cara Penyelesaian Di Qanda
 Contoh Soal Kimia Tentang Kenaikan Titik Didih Guru Paud
Contoh Soal Kimia Tentang Kenaikan Titik Didih Guru Paud
 Tetapan Kenaikan Titik Didih Molal Benzena Adalah 2 7 Oc Molal Larutan 3 Gram Zat X Dalam 100 Brainly Co Id
Tetapan Kenaikan Titik Didih Molal Benzena Adalah 2 7 Oc Molal Larutan 3 Gram Zat X Dalam 100 Brainly Co Id
 Titik Didih Pengertian Kenaikan Rumus Dan Contoh Soal
Titik Didih Pengertian Kenaikan Rumus Dan Contoh Soal
 Kimia Di Sekitar Kita Materi Kenaikan Titik Didih Tb Dan Penurunantitik Beku Tf Larutan Elektrolit Dan Nonelektrolit
Kimia Di Sekitar Kita Materi Kenaikan Titik Didih Tb Dan Penurunantitik Beku Tf Larutan Elektrolit Dan Nonelektrolit