Secara keselurahan reaksi tersebut adalah reaksi orde 3. Mol 2 liter-1 detik-1 C.
 Rumus Laju Reaksi Orde Nol Edukasi Lif Co Id
Rumus Laju Reaksi Orde Nol Edukasi Lif Co Id
Orde reaksi dua.

Satuan tetapan kecepatan reaksi untuk reaksi orde dua adalah. Menentukan persamaan laju reaksinya dengan orde reaksi yang. Suatu reaksi yang diturunkan secara eksperimen dinyatakan dengan rumus kecepatan reaksi. Orde reaksi adalah banyaknya faktor konsentrasi zat reaktan yang mempenga-ruhi kecepatan reaksi.
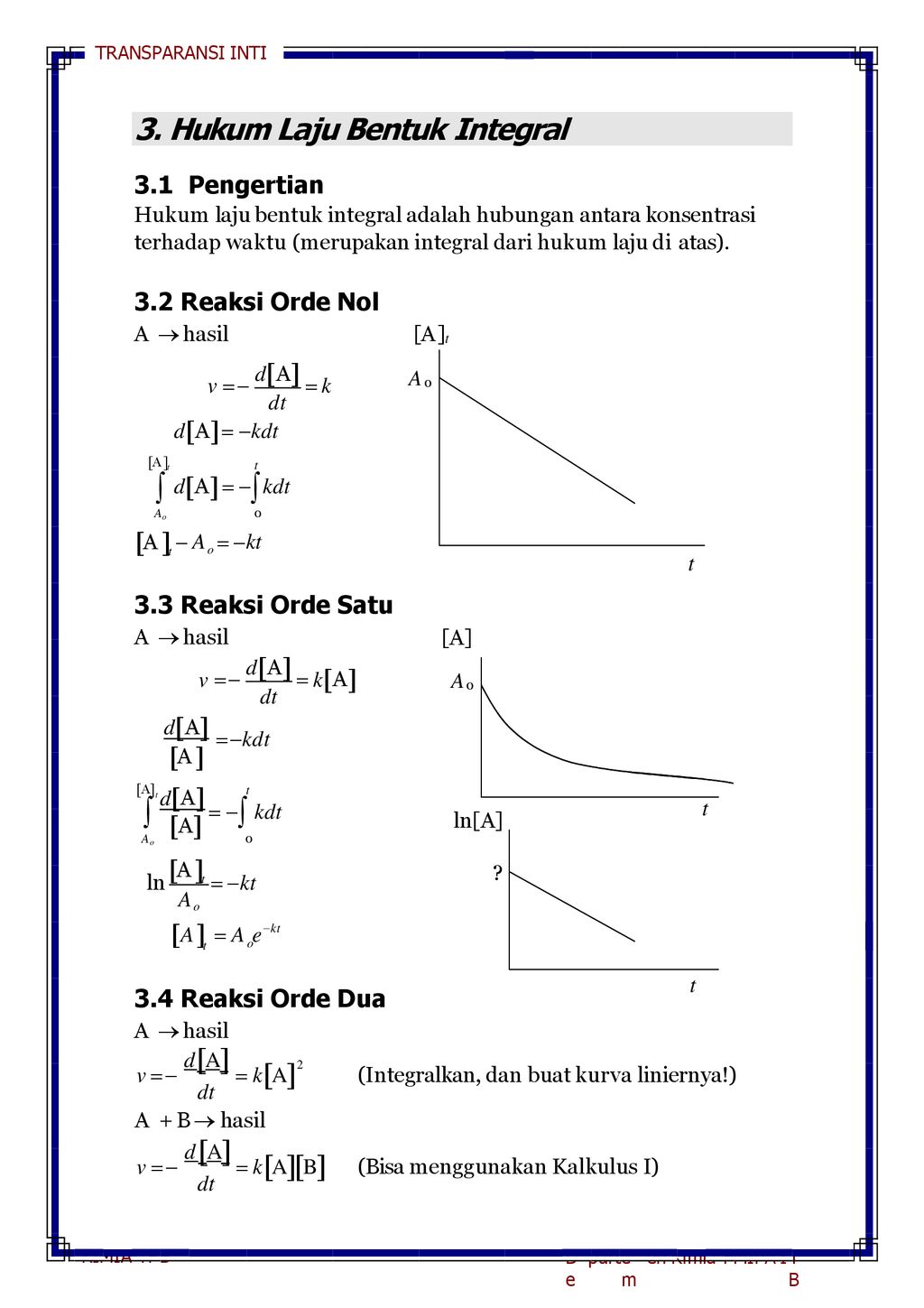
Persamaan waktu paruh untuk masing-masing orde reaksi adalah sebagai berikut. R kA 1 Persamaan reaksi orde satu merupakan persamaan linier berarti laju reaksi berbanding lurus terhadap konsentrasinya pereaksinya. Pada reaksi kimia dengan orde dua besarnya laju reaksi adalah pangkat dua dari peningkatan konsentrasi reaktannya.
Mol-1 liter 1 detik-1 Soal 7 Konsentrasi dinaikkan atau diturunkan tetapi laju reaksi tidak berubah atau tetap maka orde reaksinya adalah. Secara keselurahan reaksi tersebut adalah reaksi orde. Orde reaksi terhadap A 1 dan orde reaksi terhadap B 12 orde reaksi keseluruhan n 1 ½ 1½ atau 32 Satuan tetapan laju reaksi secara umum k mol L 1 1n menit 1 k mol L 1 1n menit 1.
Tetapan laju reaksi k memiliki satuan yang bergantung pada orde secara keseluruhan persamaan reaksi. V kecepatan reaksi k tetapan laju reaksi x orde reaksi terhadap zat A y orde reaksi terhadap zat B x y adalah orde reaksi keseluruhan A dan B adalah konsentrasi zat pereaksi. Jika konsentrasi dinyatakan dalam mol L 1 dan satuan dalam menit tentukan satuan untuk tetapan laju reaksinya.
Mol 2 liter 1 detik-1 E. V kA x B y. Mol 2 liter-2 detik-1 D.
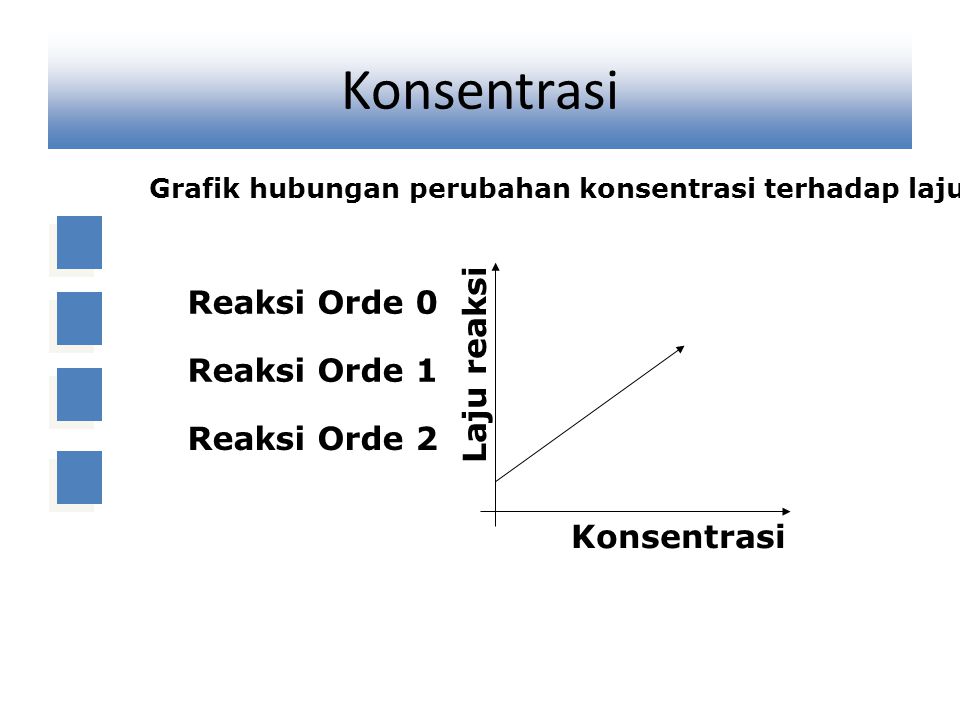
Misalnya jika konsentrasi reaktan ditingkatkan 2 kali semula maka laju reaksi akan meningkat 2 2 atau 4 kali dari semula. Konsentrasi dan kecepatan reaksi Kecepatan reaksi adalah banyaknya molliter suatu zat yang dapat berubah menjadi zat lain dalam setiap satuan waktu. V kA x B y dimana.
V k A B 2. Satuan tetapan jenis reaksi untuk reaksi tingkat 2 adalah. AA bB à c C d D Maka kecepatan reaksi untuk masing-masing zat dari persamaan reaksi di atas adalah.
Secara umum kecepatan reaksi dapat dirumuskan sebagai berikut. Suatu reaksi dikatakan berorde dua terhadap salah satu reaktan jika laju reaksi merupakan pangkat dua dari konsentrasi reaktan itu. M detik -1 M-1 detik M-2 detik -2 M-1 detik-1.
Satuan tetapan kecepatan reaksi untuk reaksi orde dua adalah. Jika konsentrasi reaktan itu dilipat-tigakan maka laju reaksi akan menjadi 3 2 atau 9 kali lebih besar. Pada reaksi kimia dengan orde negatif laju reaksi bebanding terbalik dengan konsentrasi reaktannya.
Menentukan orde masing-masing pereaksi. Perhatikan gambar di bawah iniC14 cmLuas bangun di atas adalah Jika massa jenis didefinisikan sebagai massa setiap satuan volume tentukan massa jenis benda tersebut mohon di jawab yang benar suhu sebuah filamen lampu listrik yang sedang menyala adalah 2773 kberapakah suhu flamen lampu tersebut dalam skala celciusreamur dan fahrenheit. Mol-1 liter 1 detik-1 B.
Penentuan orde reaksi tidak dapat diturunkan dari persamaan reaksi tetapi hanya dapat ditentukan berdasarkan percobaanSuatu reaksi yang di-turunkan secara eksperimen dinyatakan dengan rumus kecepatan reaksi. Untuk orde satu persamaan laju reaksi adalah. Untuk reaksi orde I v kA satuan v adalah mol dm-3 s-1 dan A adalah mol dm-3 sehingga satuan dari k untuk reaksi orde satu adalah s-1 Mulyani 2004160.
Secara umum kecepatan reaksi dapat dirumuskan sebagai berikut. 1 dA 1 dB 1 dM 1 dN V - ----- - ----- ----- -----. Untuk menentukan harga k dari suatu persamaan reaksi dapat dilakukan dengan cara berikut.
V kecepatan reaksi k tetapan laju reaksi x orde reaksi terhadap zat A y orde reaksi terhadap zat B x y adalah orde reaksi keseluruhan A dan B adalah konsentrasi zat pereaksi. Satuan tetapan atau koefisien laju bergantung pada orde reaksi. AA bB mM nN maka kecepatan reaksinya adalah.
Persamaan tersebut mengandung pengertian reaksi orde 1 terhadap zat A dan merupa-kan reaksi orde 2 terhadap zat B. Persamaan tersebut mengandung pengertian reaksi orde 1 terhadap zat A dan merupakan reaksi orde 2 terhadap zat B. T 12 ln 2 k 0693 k waktu paruh tidak bergantung pada konsentrasi awal reaktan Orde Dua.
Penentuan orde reaksi tidak dapat diturunkan dari persamaan reaksi tetapi hanya dapat ditentukan berdasarkan percobaan. V k A B 2. VA VB VC VD.
Pengertian Kecepatan reaksi adalah banyaknya konsentrasi suatu zat yang dapat berubah menjadi zat lain dalam setiap satuan waktu. Tetapan laju reaksi tersebut disimbolkan dengan huruf k. T 12 1 kA 0 waktu paruh berbanding terbalik dengan konsentarsi awal reaktan.
Satuan tetapan jenis reaksi k tergantung pada tingkat reaksi.
 Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
 Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
 D A V D B D C 1 Laju Reaksi 2 Hukum Laju Dan Orde Reaksi Ppt Download
D A V D B D C 1 Laju Reaksi 2 Hukum Laju Dan Orde Reaksi Ppt Download
 Kinetika Kimia Bab X Kinetika Kimia 1 Laju
Kinetika Kimia Bab X Kinetika Kimia 1 Laju
 Bab 3 Laju Reaksi Bahan Ajar Mata Pelajaran
Bab 3 Laju Reaksi Bahan Ajar Mata Pelajaran
 Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
 Menentukan Satuan Tetapan Laju Reaksi Orde Pertama Ksm 2014 Kabupaten Kota Youtube
Menentukan Satuan Tetapan Laju Reaksi Orde Pertama Ksm 2014 Kabupaten Kota Youtube

 Laju Reaksi Xi Ipa 3 Kelompok 3
Laju Reaksi Xi Ipa 3 Kelompok 3
 Standar Kompetensi 3 Memahami Kinetika Reaksi Kesetimbangan Kimia
Standar Kompetensi 3 Memahami Kinetika Reaksi Kesetimbangan Kimia
 Reaksi Orde Tiga Mempunyai Satuan Tetapan Laju Reaksi Brainly Co Id
Reaksi Orde Tiga Mempunyai Satuan Tetapan Laju Reaksi Brainly Co Id
 Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
 Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
Memahami Grafik Tentang Laju Reaksi Dan Variasi Soal Urip Dot Info
 Persamaan Laju Reaksi Penjelasan Rumus Contoh Soal Dan Jawaban
Persamaan Laju Reaksi Penjelasan Rumus Contoh Soal Dan Jawaban
 1 Grafik Yang Menyatakan Reaksi Orde Satu Adalah A 1b 2c 3d 4e 52 Grafik Yang Menyatakan Reaksi Brainly Co Id
1 Grafik Yang Menyatakan Reaksi Orde Satu Adalah A 1b 2c 3d 4e 52 Grafik Yang Menyatakan Reaksi Brainly Co Id
 Rumus Laju Reaksi Orde Nol Edukasi Lif Co Id
Rumus Laju Reaksi Orde Nol Edukasi Lif Co Id
 Laju Reaksi Menyatakan Besarnya Perubahan Konsentrasi Pereaksi Atau Hasil Reaksi Persatuan Waktu Dt Produk D Reaktan R Ppt Download
Laju Reaksi Menyatakan Besarnya Perubahan Konsentrasi Pereaksi Atau Hasil Reaksi Persatuan Waktu Dt Produk D Reaktan R Ppt Download
 Persamaan Laju Reaksi Dan Grafik Orde Konsep Mudah Youtube
Persamaan Laju Reaksi Dan Grafik Orde Konsep Mudah Youtube
