Jika 1 mol H2SO4 dilarutkan dalam 100 gram air dan dipanaskan tentukan kenaikan titik didih dan titik didih larutan tersebut. Larutan B dibuat dengan malerutkan 505 gram KNO3 Mr 101 ke dalam 500 gr air.
 Kimia Di Sekitar Kita Materi Kenaikan Titik Didih Tb Dan Penurunantitik Beku Tf Larutan Elektrolit Dan Nonelektrolit
Kimia Di Sekitar Kita Materi Kenaikan Titik Didih Tb Dan Penurunantitik Beku Tf Larutan Elektrolit Dan Nonelektrolit
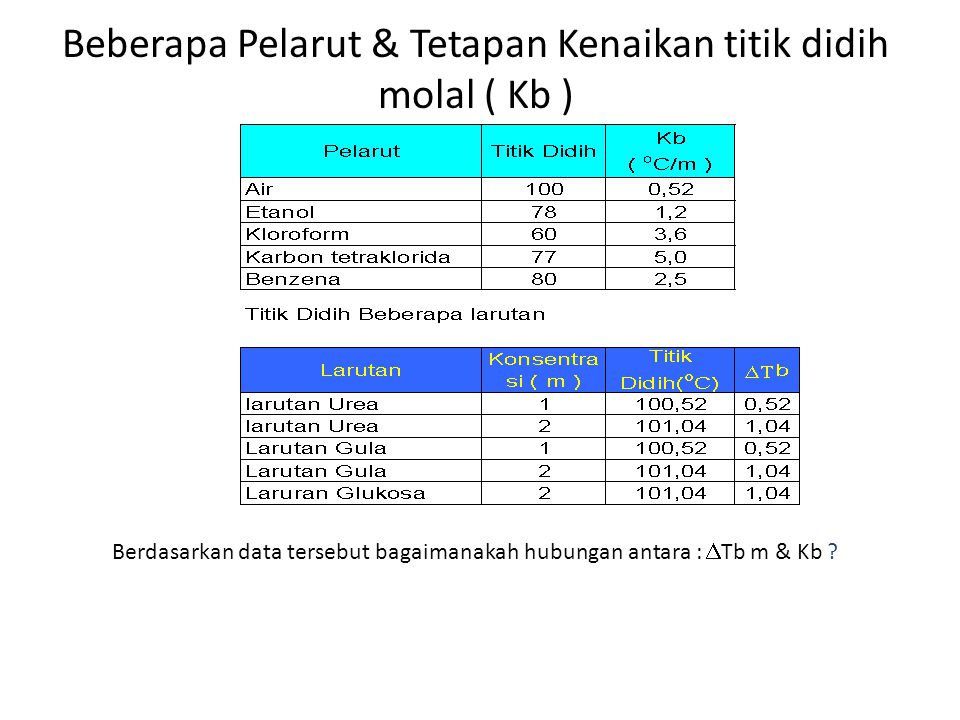
Tb Kb u m u n 05 u 1 u 3 Tb 15 C Titik didih larutan 100 C 15 C 1015 C.

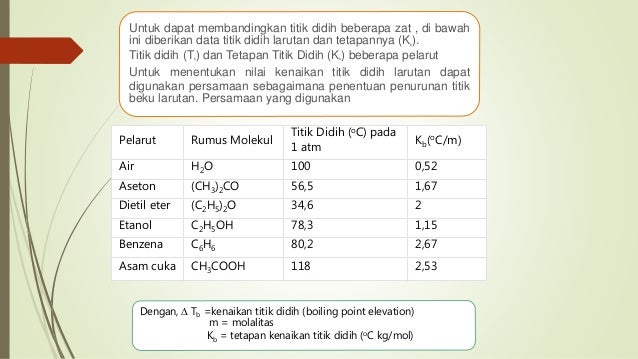
Tetapan titik didih air. Larutan dapat dibagi menjadi dua berdasarkan nilai titik didih zat terlarut. Sebanyak 1500 g timbel Pb pada suhu air mendidih 100 o C dicelupkan ke dalam 500 g air bersuhu 220 o C dalam gelas piala yang terisolasi hanya terjadi pertukaran kalor antara Pb dan air. Sebanyak 8 gram sukrosa mr342 gmol dilarutkan dalam 60 gram air menyebabkan kenaikan titik didih 02 derajat c.
Pada larutan encer kenaikan titik didi larutan ΔTb sama dengan molalitas m larutan yang mengandung pertikel zat terlarut nonvolatil dikalikan dengan tetapan kenaikan titik didih molal K b. ΔTb 1001C 100C. Kb tetapan kenaikan titik didih molal ΔTf penurunan titik beku Kf tetapan titik beku molal m molalitas.
Hal itu disebabkan selain harus mencapai suhu di mana pelarut murni mulai mendidih misal air 100ÂC juga sekaligus harus melampaui titik didih zat terlarut. PENENTUAN TITIK DIDIH AIR. Tentukan tekanan osmosis 2925 gram NaCl dalam.
Kenaikan titik didih ini dirumuskan. Ternyata larutan tersebut mendidih pada suhu 8253C dan Kb. Berapa berat gula yang harus dilarutkan untuk menaikkan titik didih 250 mL air menjadi 1001C pada tekanan 1 atm jika Mr gula 342 dan Kb 05 Cm.
23 tentang Sifat Koligatif Larutan Elektrolit. Jadi tetapan kenaikan titik didih molal air dalam larutan glukosa dan NaCl adalah 052 mol A. Ini berarti bahwa titik didih pelarut.
Titik didih pelarut misal air 100C Suatu larutan mempunyai titik didih yang lebih tinggi dibandingkan dengan titik didih pelarut murninya. Keterangan ΔT b kenaikan titik didih larutan. Oleh dosenpendidikan Diposting pada 04042021.
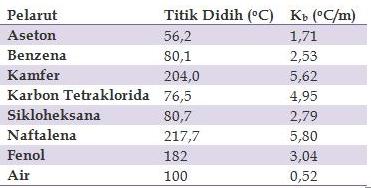
Titik didih adalah suhu ketika tekanan uap sebuah zat cair sama dengan tekanan eksternal yang dialami oleh cairan. Kenaikan titik didih juga demikian. Tetapan kenaikan titik didih molal air adalah 05 Cm.
Tetapan kenaikan titik didih molal air adalah 052. Jika tetapan titik beku molal air 186Cm derajat ionisasi garam MgCl2 adalah. Larutan B dengan melarutkan 505 g KNO 3 Mr 101 ke dalam 500 g air.
Tb pelarut. Menunjukan bahwa titik didih air bergantung pada tekanan P dapat mencatat data temperatur dan sesuai dengan tekanan sistim sesuai dengan kurva titik didih air. Pertama adalah titik didih zat terlarut lebih kecil daripada.
Mg 24 Cl 355. Air dalam suatu wadah yang tertutup dimana sedang mendidih akan menghasilkan banyak gelembung besar yang terbentuk dalam wadah dan muncul kepermukaan. Dalam 250 gram air dilarutkan 19 gram MgCl2 ternyata larutan membeku pada 0372C.
Brapakah tetapan kenaikan titik didih air kb. Jika tetapan titik beku molal air 186Cm derajat ionisasi garam MgCl2 adalah. 0052 Mr 052 20Mr.
ΔT b T b T b o m K b. Kedua senyawa tersebut terionisasi sempurna dalam air. Hubungan antara kenaikan.
Jika tetapan kenaikan titik didih molal Kb air adalah 052 C molal tentukan massa molekul relatif zat X. Larutan A dibuat dengan melarutkan 95 g MgCl 2 Mr 95 ke dalam 500 g air. Berlawanan dengan penurunan titik beku larutan kenaikan titik didih larutan merupakan fenomena meningkatkan titik didih suatu pelarut disebabkan adanya zat terlarut didalam pelarut tersebut.
Cairan yang berada di dalam tekanan tinggi akan memiliki titik didih lebih tinggi jika dibandingkan dari titik. Tetapan kenaikan titik didih molal air adalah 052. ΔTd titik didih larutan titik didih pelarut murni 4.
ΔTd titik didih larutan titik didih pelarut murni 100052C 100C 0052C ΔTd Kd m. Hubungan tekanan udara dengan titik didih air. Perbandingan Tb larutan A terhadap Tb larutan B adalah.
Kedua senyawa tersebut terionisasi sempurna dalam air. 10001000 200 Jawab. Sebuah cairan di dalam vacuum akan memiliki titik didih yang rendah dibandingkan jika cairan itu berada di dalam tekanan atmosfer.
Dalam 250 gram air dilarutkan 19 gram MgCl2 ternyata larutan membeku pada 0372C. Larutan A dibuat dengan melarutkan 95 g MgCl2 Mr 95 ke dalam 500 gram air. KENAIKAN TITIK DIDIH fDasar Teori Titik didih adalah suhu dimana cairan mendidih dimana tekanan uap sebuah zat cair sama dengan tekanan eksternal yang dialami cairan.
Kedalam 25 gram benzena dilarutkan 25 gram zat Y. Perdalam materi ini di Pembahasan Kimia UN.
 Titik Beku Dan Penurunan Titik Beku Nonelektrolit
Titik Beku Dan Penurunan Titik Beku Nonelektrolit

 Titik Didih Pengertian Kenaikan Rumus Dan Contoh Soal
Titik Didih Pengertian Kenaikan Rumus Dan Contoh Soal
 Kimia Kelas Iii Ipa Semester I Ppt Download
Kimia Kelas Iii Ipa Semester I Ppt Download
 Sifat Koligatif Larutan Ppt Download
Sifat Koligatif Larutan Ppt Download
 Kimia Di Sekitar Kita Materi Kenaikan Titik Didih Tb Dan Penurunantitik Beku Tf Larutan Elektrolit Dan Nonelektrolit
Kimia Di Sekitar Kita Materi Kenaikan Titik Didih Tb Dan Penurunantitik Beku Tf Larutan Elektrolit Dan Nonelektrolit

 All About Education Sifat Koligatif Larutan Kimia Xii
All About Education Sifat Koligatif Larutan Kimia Xii
 Titik Didih Pengertian Kenaikan Rumus Dan Contoh Soal
Titik Didih Pengertian Kenaikan Rumus Dan Contoh Soal
 Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
 Kenaikan Titik Didih Sifat Koligatif Larutan Nonelektrolit Rumus Kimia
Kenaikan Titik Didih Sifat Koligatif Larutan Nonelektrolit Rumus Kimia
 Diketahui Tetapan Kenaikan Titik Didih Molal Air 0 52 Derajat Celcius Larutan Itu Mengandung 4 Brainly Co Id
Diketahui Tetapan Kenaikan Titik Didih Molal Air 0 52 Derajat Celcius Larutan Itu Mengandung 4 Brainly Co Id
 Kenaikan Titik Didih Larutan Nonelektrolit
Kenaikan Titik Didih Larutan Nonelektrolit
 Jika Diketahui Tetapan Kenaikan Titik Didih Molal Air Kf Adalah 0 52 Derajat Celcius M Pangkat Min Brainly Co Id
Jika Diketahui Tetapan Kenaikan Titik Didih Molal Air Kf Adalah 0 52 Derajat Celcius M Pangkat Min Brainly Co Id
 Sifat Koligatif Larutan Beserta Soal Dan Pembahasan
Sifat Koligatif Larutan Beserta Soal Dan Pembahasan
 Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
 Tetapan Kenaikan Titik Didih Molal Air Adalah 0 52 Larutan A Dibuat Dengan Melarutkan 9 5 G Mgcl2 Brainly Co Id
Tetapan Kenaikan Titik Didih Molal Air Adalah 0 52 Larutan A Dibuat Dengan Melarutkan 9 5 G Mgcl2 Brainly Co Id